Welk effect heeft LSD op glutamaat?
LSD heeft een effect op de neurotransmitter glutamaat in de hersenen. Glutamaat is een excitatoire neurotransmitter die betrokken is bij de communicatie tussen zenuwcellen. LSD kan de activiteit van glutamaat in de hersenen veranderen door te binden aan de 5-HT2A-receptoren, die verspreid zijn in het brein.
Door de binding van LSD aan deze receptoren kan de balans tussen glutamaat en GABA veranderen. In sommige gedeelten van het brein is meer glutamaat een voordeel en in de hippocampus geeft een lager glutamaat-gehalte in verhouding tot GABA meer rust. Dit lijkt bij het gebruik van LSD het geval te zijn. Zie de werking van LSD op de afbeelding hieronder.
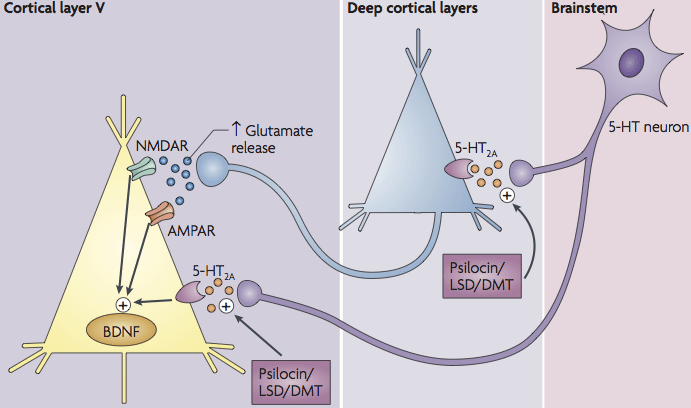
Neurobiologische mechanismen: LSD werkt primair als partiële agonist op serotonine-5-HT₂A-receptoren (evenals 5-HT₂C, 5-HT₁A, D₂, enz.). Activering van 5-HT₂A op piramidale neuronen in de cortex leidt tot toegenomen glutamaatafgifte (glutamaatrelease) in de prefrontale cortex. Tegelijkertijd kan LSD via 5-HT₁A-receptoren een remmend effect hebben (bijv. op GABA-remmende neuronen of hippocampale circuits). Zo zijn minstens twee glutamaterge routes voorgesteld: (1) 5-HT₂A-gestimuleerde excitatie van piramidale cellen die glutamaat vrijgeven, en (2) 5-HT₁A-gemedieerde toename van inhibitie (met name in hippocampus). Recent onderzoek toont bovendien dat LSD de presynaptische glutamaatdynamiek kan moduleren: in corticale neuronen reduceerde LSD bijvoorbeeld de Ca²⁺-instroom en verkleinde het het reserveblaasjespakket, wat de glutamaatafgifte kan veranderen. Deze signalen activeren downstream paden (mTOR, BDNF, etc.) die synaptische plasticiteit bevorderen.
Prefrontale cortex
- Glutamaattoename: In de prefrontale cortex (PFC) veroorzaakt LSD een sterke verhoging van extracellulair glutamaat via 5-HT₂A-agonisme. In vivo-microdialyse in ratten toonde dat LSD (0,1 mg/kg) de glutamaatconcentratie in de PFC significant verhoogt, een effect dat geblokkeerd werd door een 5-HT₂A-antagonist. Ook bleek direct infunderen van LSD in de PFC de glutamaatspiegel snel en langdurig te verhogen. Deze bevinding ondersteunt dat LSD direct glutamaatvrijgave stimuleert in cortex.
- Receptormechanismen: LSD bindt zeer sterk op corticale 5-HT₂A-receptoren, wat intracellulaire PLC/Ca²⁺-signaaltransductie activeert en glutamaatverhoging mogelijk maakt. Tegelijkertijd kan LSD 5-HT₁A-receptoren stimuleren op interneuronen, wat juist lokale inhibitie bevordert. De netto-impact in de PFC lijkt echter een duidelijke excitatie te zijn, omdat door LSD het glutamaatgehalte toeneemt.
- Gedragscorrelaten: Verhoogde glutamaat in de PFC kan neurale connectiviteit en plasticiteit vergroten. LSD verhoogt de functionele connectiviteit van de prefrontale cortex met andere hersengebieden en stimuleert lange-termijn plasticiteit via mTOR/BDNF-paden. Cognitief is PFC-activiteit cruciaal voor werkgeheugen en executieve functies: LSD verslechtert acuut werkgeheugen en cognitieve flexibiliteit, effecten die geremd worden door 5-HT₂A-blokkade. Anderzijds zijn er aanwijzingen dat LSD op middellange termijn sommige frontale geheugenprocessen kan verbeteren (b.v. betere retrieval bij bepaalde taken). Kortom, LSD’s glutamaatchanges in PFC lijken gerelateerd aan zowel acute cognitieve stoornissen als potentiële positieve (plastische) effecten op langere termijn.
Hippocampus
- Glutamaat en receptoren: Het hippocampusgebied bevat zowel 5-HT₂A- als 5-HT₁A-receptoren. LSD’s activering van hippocampale 5-HT₂A zou in theorie glutamaat kunnen verhogen, maar verspreiding van 5-HT₁A (bijvoorbeeld op GABA-remmende neuronen) lijkt dominanter. Studies suggereren dat 5-HT₁A-stimulatie de excitatie in hippocampus juist afremt. Dit impliceert dat LSD mogelijk eerder een indirect remmend effect op hippocampale glutamaterge activatie heeft. In lijn hiermee rapporteerde een psilocybine-studie (niet LSD) juist verminderde hippocampale glutamaatsignalen tijdens “ego-dissolutie”, al is LSD-specifiek onderzoek hiernaar beperkt.
- Functionele gevolgen: Minder hippocampale glutamaat kan geheugenprocessen en zelfrepresentatie beïnvloeden. Enkele menselijke studies melden dat LSD de hippocampusbetrokken netwerkconnectiviteit verandert: verminderde parahippocampus-connectiviteit correleerde met ego-dissolutie. Cognitief kan LSD de vorming en het ophalen van herinneringen moduleren. Zoals eerder genoemd verbeteren sommige frontale geheugenfuncties na LSD, hoewel geheugen en spatial working memory vaak acuut verslechteren. Het is aannemelijk dat LSD’s neurologische impact in hippocampus deels indirect verloopt via cortico-hippocampale lussen en serotonerge modulatie (5-HT₁A), niet via directe glutamaatverhoging.
Thalamus
- Circuitseffecten: In de thalamus verstoort LSD de normale gating door de reticulaire en mediodorsale kernen. In dierstudies remde LSD bepaalde GABA-rijke reticulaire thalamusneuronengroepen, terwijl het de mediodorsale relaisneuronen (glutamaatprojecterende cellen) gedis-inhibeerde. Dit ‘opheffen van remming’ verhoogt de glutamaterge thalamocorticale output naar cortex. LSD’s werking op de thalamus berust deels op D₂-dopaminereceptoren, aangezien een D₂-blocker deze effecten verminderde.
- Neurale correlaten: Functioneel MRI-onderzoek toont dat LSD de thalamocorticale functionele connectiviteit sterk verhoogt. Deze versterkte verbindingen tussen thalamus en cortex hangen samen met hallucinogene beleving. In combinatie met de gedragsdata dat LSD sensorische gating verstoort (bijv. verminderde pre-pulse inhibitie), duidt dit erop dat LSD via glutamaterge thalamocorticale paden de zintuiglijke filtering vermindert. Zo kunnen sensorische impulsen ongefilterd de cortex bereiken, wat hallucinaties en intensere percepties verklaart.
Overige hersengebieden en circuits
LSD heeft ook invloed op andere glutamaterge netwerken. Bijvoorbeeld in de visuele cortex vinden we veel 5-HT₂A-receptoren; LSD verhoogt de activiteit en connectiviteit van V1 sterk, wat samenhangt met visuele hallucinaties. Verder beïnvloedt LSD mesocorticolimbische paden (D₂- en 5-HT₁A-actie in ventrale striatum) en sensorische cortex, maar specifieke glutamaatchanges zijn hier weinig onderzocht. In het algemeen lijkt LSD voornamelijk de glutamaterge neurotransmissie in het cortex-brede netwerk te ‘fluten’ (frontaal, visueel) terwijl subcorticale remming (thalamus) wordt opgeheven.
Gedrags- en cognitieve correlaten
LSD’s glutamaatmodulatie gaat gepaard met duidelijk meetbare gedragsveranderingen. Acuut vermindert LSD werkgeheugen, flexibiliteit en executieve functies – waarschijnlijk door overactivatie van prefrontale circuits via 5-HT₂A. Intrigerend genoeg tonen sommige tests juist verbeteringen in frontaal-afhankelijke geheugenopdrachten na LSD, mogelijk gerelateerd aan de langere-termijn plasticiteitsbevorderende effecten van extra glutamaat. Subjectief ervaren gebruikers sterke hallucinaties, die neurobeeldstudies koppelen aan verhoogde corticale glutamatexcitatie: bijv. grotere connectiviteit van de visuele cortex correleert met scores op visuele hallucinaties. Ego-dissolutie hangt samen met verminderde communicatie tussen hippocampale/parahippocampale gebieden en de cingulate cortex, wat past bij psychedelica-onderzoek waarin glutamaatveranderingen in deze regio’s de zelfrepresentatie beïnvloeden. Ook werd geobserveerd dat LSD positieve sociale en emotionele effecten (meer empathie, verbondenheid) induceert, mogelijk door ontremming van glutamaterge top-down beïnvloeding van limbische systemen.
Samenvatting: Recente literatuur bevestigt dat LSD via 5-HT₂A-receptoren een toename van glutamaattransmissie in de hersenschors veroorzaakt, vooral in de prefrontale regio’s. Tegelijkertijd speelt 5-HT₁A-remming een rol in hippocampus en andere gebieden. Dit resulteert in een verstoring van het excitatie-inhibitie-evenwicht: thalamus en cortex raken overgestimuleerd, wat perceptuele en cognitieve veranderingen verklaart. Al deze bevindingen zijn ondersteund door dier- en humane studies (microdialyse, beeldvorming, elektrofisiologie) en gelinkte aan gedragsuitkomsten, zoals geheugenprestaties en subjectieve hallucinaties.