Psychedelica en BDNF
Psychedelica zoals paddo's, truffels, LSD of psilocybine staan er om bekend om meer BDNF vrij te laten komen in het brein. Zoals we eerder beschreven kan meer BDNF een gunstig effect heb op neurodegeneratieve aandoeningen zoals Parkinson Alzheimer en MS.
Wat is de interactie tussen het TAU eiwit en BDNF?
BDNF staat bekend om zijn rol bij het bevorderen van de overleving en groei van neuronen, met name dopaminerge neuronen. Deze dopaminerge neuronen zijn belangrijk omdat ze zijn aangetast in de ziekte van Parkinson. Dus in de context van de ziekte van Parkinson zou BDNF de overleving en gezondheid van dopaminerge neuronen kunnen beïnvloeden en beschermen.
Tau-eiwit wordt meestal in vehoogde concentraties gevonden bij andere neurodegeneratieve aandoeningen, zoals de ziekte van Alzheimer, waarbij Tau-eiwitafzettingen in de hersenen worden aangetroffen. Bij de ziekte van Alzheimer zijn er aanwijzingen dat het Brain-Derived Neurotrophic Factor (BDNF) invloed kan hebben op het Tau-eiwit, zij het indirect. De ziekte van Alzheimer wordt gekenmerkt door de abnormale ophoping en aggregatie van Tau-eiwit en beta-amyloïde-eiwit in de hersenen. BDNF speelt een belangrijke rol bij het bevorderen van de overleving en de gezondheid van neuronen in de hersenen, en het kan verschillende effecten hebben op Tau-eiwit in de volgende manieren:
-
Bescherming van neuronen: BDNF kan de overleving en gezondheid van neuronen bevorderen, inclusief de neuronen die betrokken zijn bij het transport van Tau-eiwit. Dit kan helpen bij het voorkomen van de schadelijke effecten van Tau-eiwitophoping.
-
Regulering van Tau-fosforylering: Tau-eiwit moet normaal gesproken correct gefosforyleerd zijn om zijn functie in het stabiliseren van microtubuli in neuronen uit te oefenen. Abnormale fosforylering van Tau kan leiden tot de vorming van Tau-tangles, een kenmerk van de ziekte van Alzheimer. BDNF kan de fosforylering van Tau beïnvloeden en mogelijk helpen bij het voorkomen van pathologische veranderingen in Tau-eiwit.
-
Stimulering van neuroplasticiteit: BDNF kan de neuroplasticiteit bevorderen, wat het vermogen van de hersenen om te leren en zich aan te passen aan veranderingen in de omgeving is. Dit kan indirect de ernst van Alzheimer-symptomen verminderen.
Meer informatie over BDNF
Lees ook ons laatste bericht over BDNF of neuroplasticiteit via de volgende links:
Effecten van psilocine op Alzheimer en TAU-eiwitten
Huidige wetenschappelijke studies
Impact op neurodegeneratieve ziekten (Alzheimer):
Recente onderzoeken suggereren dat psilocybine (en zijn actieve metaboliet psilocine) potentieel gunstige effecten kan hebben op neurodegeneratieve aandoeningen zoals de ziekte van Alzheimer (AD). Hoewel direct onderzoek naar psilocine bij Alzheimer nog beperkt is, tonen reviews en preklinische studies aan dat klassieke psychedelica neurogenese kunnen stimuleren, neuroplasticiteit bevorderen en neuro-inflammatie verminderen. Dit is relevant omdat AD wordt gekenmerkt door verlies van synapsen, neuronaal afsterven en ontstekingsprocessen in de hersenen. Psychedelica zoals psilocybine zijn krachtige agonisten van serotonine-(5-HT)_2A-receptoren en induceren breed veranderingen in hersennetwerken en plasticiteit. Er is anekdotisch bewijs dat microdoseren (sub-perceptuele doses) van psychedelica de cognitie kan verbeteren, wat de interesse wekt voor toepassing bij vroege dementie. In een muismodel van hippocampus-gebaseerd leren is bijvoorbeeld gevonden dat zowel lage als hoge doses psilocybine het compleet uitdoven van geconditioneerde vreesreacties versnellen, wat wijst op verbeterde cognitieve flexibiliteit. Ook zagen Catlow et al. (2013) dat psilocybine de vorming van nieuwe neuronen in de hippocampus stimuleerde (hippocampale neurogenese) bij muizen, wat gepaard ging met beter herstel van herinneringen. Dergelijke resultaten ondersteunen het idee dat psilocybine/psilocine gunstig kan zijn voor neuronale gezondheid en geheugenfuncties.
Invloed op TAU-eiwit aggregatie:
Het directe effect van psilocine op TAU-eiwitpathologie is nog niet uitvoerig onderzocht. AD wordt gekenmerkt door intracellulaire ophopingen van hypergefosforyleerd tau-eiwit (neurofibrillaire kluwens) die samen met amyloïd-plaques bijdragen aan neuronale disfunctie. Specifieke studies die aantonen dat psilocine tau-aggregatie vermindert, zijn schaars. Er zijn echter aanwijzingen uit verwant onderzoek dat psychedelica indirect de tau-pathologie kunnen beïnvloeden. Een preklinisch voorbeeld komt uit een rattenmodel van mild hersentrauma: behandeling met psilocybine leidde tot verlaagde niveaus van gehyperfosforyleerd tau in de hersenen. Bovendien steeg in die studie de concentratie van BDNF (brain-derived neurotrophic factor) – een groeifactor die bekend staat om het beschermen tegen tau-gerelateerde neurodegeneratie. Daarnaast is bekend dat bepaalde beta-carboline psychedelica (zoals harmine, een component van ayahuasca) de tau-fosforylering op AD-gerelateerde plaatsen kunnen verlagen. Deze bevindingen suggereren dat activatie van bepaalde celroutes door psychedelica tau-opstapeling kan tegengaan, hoewel psilocine zelf hierin nog nader onderzocht moet worden. Tot op heden liggen de focus van studies vooral op symptomen en algemene neuroprotectie, niet direct op tau-opruiming; toekomstig onderzoek (bijvoorbeeld in diermodellen met taupathologie) is nodig om te bevestigen of psilocine tau-kluwen kan verminderen.
Onderzoeksmethoden (in vitro, in vivo, klinisch):
De huidige kennis komt uit een mix van laboratoriumonderzoek en vroege klinische verkenningen. In vitro-studies hebben cellulaire effecten van psilocine onderzocht: zo toonde een studie met microglia (immuuncellen van de hersenen) aan dat psilocine ontstekingsmarkers kan moduleren. In gekweekte microglia verminderde psilocine de productie van reactieve zuurstofspecies (ROS) aanzienlijk, evenals de afgifte van stikstofmonoxide (NO), via activatie van 5-HT_2-receptoren. Deze celmodellen ondersteunen een ontstekingsremmend effect (relevant omdat chronische neuroinflammatie bijdraagt aan AD). In vivo-studies (diermodellen) laten zien dat psilocybine/psilocine neurologische functies kan verbeteren. Bij muizen en ratten zijn experimentele toedieningen gebruikt om effecten op neuroplasticiteit en gedrag te meten. Voorbeelden zijn bovengenoemde muizenstudies waarin psilocybine neurogenese stimuleerde en leerprocessen versnelde, en ratstudies waarin psilocybine hersenschade door trauma beperkte (minder MRI-abnormaliteiten, minder tau-pathologie). Ook in een ratmodel van door streptozotocine geïnduceerde Alzheimer (STZ-AD model) bleken 5-HT1A/2A agonisten neuroprotectief: ze voorkwamen celdood in de hippocampus via anti-apoptotische en ontstekingsremmende routes. Dit suggereert dat middelen als psilocine, die op dezelfde receptoren werken, vergelijkbare bescherming kunnen bieden. Klinische studies staan nog in de kinderschoenen. Er zijn tot nu toe geen grootschalige klinische trials die aantonen dat psilocine effectief AD-processen verandert. Wel lopen er kleinschalige klinische onderzoeken gericht op symptomatische verbetering: zo is een pilotstudie gestart om psilocybine te testen bij patiënten met milde cognitieve impairment (MCI) of vroege Alzheimer die lijden aan depressie (NCT04123314). Deze studie onderzoekt primair of psilocybine veilig depressieve symptomen vermindert en de levenskwaliteit verbetert bij beginnende dementie. Resultaten worden eind 2023 verwacht. Daarnaast is er interesse in de toepassing van microdosering bij ouderen met cognitieve achteruitgang, maar dit bevindt zich vooralsnog op anekdotisch en exploratief niveau. Tabel 1 hieronder geeft een overzicht van representatieve studies en hun bevindingen:
| Studie (jaar) | Model / methode | Belangrijkste bevindingen (relevant voor AD/TAU) |
|---|---|---|
| Shahidi et al., 2019 | Ratmodel (STZ-geïnduceerd Alzheimer) | 5-HT1A/2A-receptoragonisten beschermden hippocampale neuronen via anti-apoptotische en ontstekingsremmende effecten. |
| Catlow et al., 2013 | Muizen (trace fear conditioning taak) | Psilocybine verhoogde hippocampale neurogenese en versnelde het uitdoven van angstgeconditioneerde herinneringen. |
| Shao et al., 2021* | Muizen (acute toediening psilocybine) | Psilocybine (1 mg/kg) verhoogde de dichtheid van dendritische spines in de frontale cortex (effect sterker bij vrouwtjes). |
| Wiens et al., 2023 | In vitro – microgliale cellen | Psilocine (≤10 µM) onderdrukte de “respiratory burst” in humane microglia-achtige cellen (minder ROS-productie) en verminderde NO-afgifte via 5-HT_2-receptoractivatie. |
| Ferris et al., 2025 | Ratmodel, herhaalde milde hersentrauma | Psilocybine (3 mg/kg, i.p.) toediening verminderde hypergefosforyleerd tau (NFT-markers) en verhoogde BDNF-niveaus; tevens verbetering in MRI-biomarkers na trauma. |
| NCT04123314 (lopend) | Klinisch – patiënten met MCI/vroege AD + depressie | Psilocybine-geassisteerde therapie om depressie bij beginnende Alzheimer te verlichten (focus op stemming en levenskwaliteit). Status: fase-1 veiligheidsstudie; resultaten in afwachting. |
*Voetnoot: Shao et al. 2021 verwijst naar recent werk vermeld in literatuur; exacte referentiejaar onder voorbehoud.
Theoretische werkingsmechanismen
Neuroprotectieve effecten van psilocine:
Op basis van de bovenstaande studies en bekende farmacologie zijn verschillende mechanismen geopperd waardoor psilocine neuroprotectief kan zijn. Ten eerste bevordert psilocine neuroplasticiteit. Onder invloed van psilocybine/psilocine worden signaalroutes in neuronen geactiveerd die leiden tot de groei van nieuwe verbindingen en versterking van synapsen. Dierstudies tonen een toename van dendritische spines (uitsteeksels op neuronen die synaptisch contact maken) na psilocybinegebruik. Ook is er een toename van neurotrofe factoren zoals Brain-Derived Neurotrophic Factor (BDNF) waargenomen. BDNF ondersteunt de overleving van neuronen en bevordert herstel; interessant is dat hogere BDNF-niveaus correleren met bescherming tegen tau-geïnduceerde neurodegeneratie. Ten tweede heeft psilocine ontstekingsremmende en anti-oxidatieve eigenschappen. Overmatige neuro-inflammatie is een drijvende kracht achter schade bij Alzheimer. Psilocine kan via microglia-modulatie dit proces afremmen: blootstelling van microgliale cellen aan psilocine verlaagt de productie van pro-inflammatoire moleculen (zoals ROS en NO) die anders bij zouden dragen aan oxidatieve stress en celschade. Dit duidt op een neuro-immuunmodulerend effect, wat neuronale overleving ten goede kan komen in een ontstoken AD-brein. Bovendien suggereren modellen dat 5-HT_2A-agonisten anti-apoptotische signalen in gang zetten, waardoor neuronen minder snel geprogrammeerde celdood ondergaan in ziektemodellen. Ten derde kan psilocine indirect cognitieve functies verbeteren door symptomen zoals depressie en angst te verlichten. AD-patiënten met minder depressie/anxiety vertonen langzamere cognitieve achteruitgang; psilocybine is bekend om sterke en duurzame verbeteringen in depressieve klachten te geven bij therapieresistente patiënten in andere contexten. Door stemming en angst te verbeteren, zou psilocine secundair ook een beschermend effect op cognitieve achteruitgang kunnen hebben.
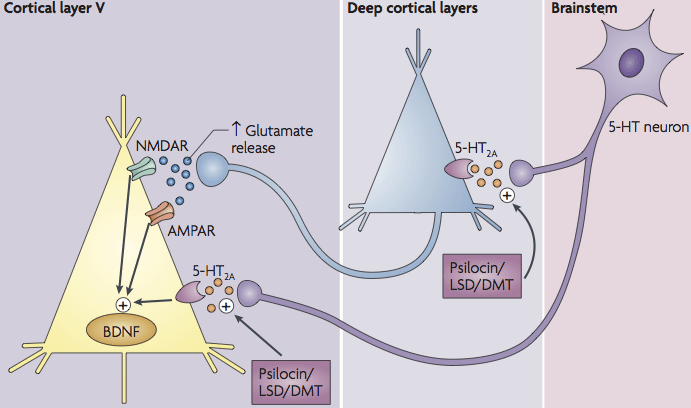
Biochemische paden (TAU-eiwit, neuronale gezondheid):
Verscheidene cellulaire paden kunnen betrokken zijn bij de effecten van psilocine, die mogelijk relevant zijn voor tau-eiwitophoping en neuronale gezondheid. Een belangrijk pad is het BDNF/TrkB-signaal gekoppeld aan mTOR. Wanneer psilocine via 5-HT_2A-receptoren neuronale activiteit verhoogt, kan dit leiden tot afgifte van glutamaat en activering van TrkB (de BDNF-receptor). Hierdoor wordt de mTOR-route geactiveerd, wat resulteert in fosforylatie van CREB (een transcriptiefactor) en verhoogde expressie van genen die samenhangen met synaptische groei en plasticiteit. Dit mechanisme verklaart deels de psychoplastogene effecten (structurele hersenplasticiteit) van psychedelica. Echter, mTOR speelt een complexe rol bij Alzheimer: overmatige mTOR-activiteit kan autofagie remmen, een proces dat nodig is om misgevouwen eiwitten op te ruimen. Bij AD-patiënten is gezien dat hyperactief mTOR samenhangt met toename van amyloïd-β en tau-fosforylering. Theoretisch is het dus van belang dat een behandeling met psilocine wel de plasticiteit verhoogt maar niet pathologisch mTOR overactiveert. Vooralsnog is er geen evidentie dat psilocybine dit soort nadelige effecten heeft – men speculeert zelfs dat psilocybine via gecontroleerde mTOR-activatie juist opruiming van eiwitaggregaten zou kunnen faciliteren. In een 5xFAD muismodel (familiaire AD) bleek activering van mTOR in microglia bijvoorbeeld de expressie van TREM2 te verhogen en amyloïd-plaque-opruiming te bevorderen. Mogelijk zou psilocine een vergelijkbaar mechanisme kunnen aanwenden om amyloïd- en tau-afbraak te ondersteunen, maar dit blijft vooralsnog hypothetisch. Andere biochemische routes: Serotonerge activatie via 5-HT_2A kan ook invloed hebben op genexpressiepatronen die neuronale stress verminderen. Bijvoorbeeld, stimulatie van 5-HT_2A-receptoren kan de SIRT1/PGC-1α-route in neuronen activeren, wat de mitochondriale biogenese verbetert. Betere mitochondriale functie betekent minder oxidatieve stress en mogelijk minder neuronale schade, wat indirect de accumulatie van tau kan beperken (aangezien stress kinases tau hyperfosforyleren). Daarnaast zijn er aanwijzingen dat serotonerge modulatie enzymen die tau fosforyleren kan beïnvloeden. Hoewel niet specifiek met psilocine onderzocht, is bekend dat chronische ontsteking en stress kinases (zoals GSK-3β, CDK5) bijdragen aan tau-pathologie; de ontstekingsremming door psilocine kan deze cascade doorbreken. Samengevat wijzen de biochemische paden erop dat psilocine een multi-factorieel effect kan hebben: het bevordert pro-survival en pro-plasticiteit signalen (BDNF/CREB, SIRT1), terwijl het schadelijke processen dempt (neuroinflammatie, oxidatieve stress, mogelijk tau-fosforylering via tussenstappen).
Rol van 5-HT2A-receptoractivatie in neurodegeneratie:
De 5-HT_2A-receptor is de primaire aangrijpingsplek van psilocine/psilocybine en speelt een sleutelrol in de besproken mechanismen. Interessant genoeg is uit post-mortem en PET-onderzoek gebleken dat de dichtheid van 5-HT_2A-receptoren verlaagd is bij Alzheimerpatiënten, en deze afname correleert met cognitieve achteruitgang. Dit wijst erop dat serotonerge signaling – met name via 5-HT_2A – betrokken is bij cognitieve functie en mogelijk bij de pathogenese van AD. Activatie van 5-HT_2A-receptoren heeft een breed scala aan effecten: in cortexneuronen kan het leiden tot afgifte van glutamaat, modulatie van genexpressie (waaronder immediate early genes als c-Fos), en het stimuleren van groeipaden (zoals hierboven beschreven). Daarnaast vormt 5-HT_2A vaak receptorkomplexen met andere receptoren (bv. mGlu2 of 5-HT1A), wat subtiele invloeden op signaalroutes geeft. Voor neurodegeneratie betekent dit dat 5-HT_2A-agonisme potentieel zowel symptomatische verlichting als ziektemodificatie kan bieden. Symptomatisch, omdat 5-HT_2A-activatie in de frontale cortex en hippocampus (gebieden aangetast bij AD) netwerken tijdelijk kan versterken en bijvoorbeeld apathie of depressieve symptomen kan verminderen. Ziektemodificerend, omdat via 5-HT_2A neuronale overlevingsmechanismen aangezwengeld worden (zoals BDNF-productie) en immuunreacties in de hersenen geshaped kunnen worden. Een voorbeeld is het effect op microglia: psilocine’s remming van microglia-ROS productie werd nagebootst door selectieve 5-HT_2A-agonisten, wat bevestigt dat juist dit receptorpad verantwoordelijk is voor de ontstekingsremming. Het therapeutisch voordeel van 5-HT_2A-activatie zou dus liggen in het herstellen van neurochemische balans die bij AD verstoord is. Niettemin zijn de hallucinogene effecten van psilocybine een direct gevolg van 5-HT_2A-agonisme in corticale circuits, wat uitdagend is bij kwetsbare patiënten. Onderzoekers bekijken daarom of 5-HT_2A-stimulatie met gematigde intensiteit (bijvoorbeeld via microdosering of via nieuwe verbindingen die het receptorcomplex anders activeren) voldoende is om neuroprotectieve voordelen te behalen zonder sterke sensorische verstoring. Samengevat speelt 5-HT_2A een centrale rol in de theoretische mechanismen waarmee psilocine neuronale gezondheid kan bevorderen, en vormt het tegelijkertijd de bron van potentieel ongewenste psychedelische bijwerkingen die gemanaged moeten worden.
Mogelijke therapeutische toepassingen
Onderzoek naar psilocine als behandeling voor Alzheimer:
Op basis van het bovenstaande wordt psilocine/psilocybine gezien als een veelbelovende, zij het experimentele, benadering voor AD. Preklinische gegevens wijzen op multimodale voordelen – van verbeterde synaptische connectiviteit tot minder neuroinflammatie – die zeer relevant zijn voor een ziekte als Alzheimer die multifactorieel is. In theorie zou psilocine gebruikt kunnen worden om zowel de kernpathologie aan te pakken (door bevordering van opruimprocessen en bescherming van neuronen) als de neuropsychiatrische symptomen van AD te verlichten (zoals depressie, angst, apathie). Dit maakt het een aantrekkelijke kandidaat voor verdere studie. Huidige therapeutische toepassingen bevinden zich echter vooral nog in de onderzoeksfase. Zoals genoemd, is er een lopende klinische trial die psilocybine inzet bij mensen met milde cognitieve klachten en depressie om te zien of dit hun welzijn verbetert. Daarnaast zijn er kleine proof-of-concept studies voorgesteld om het effect op cognitieve symptomen te meten, bijvoorbeeld of microdoseren van psilocine de geheugenfunctie in vroege AD kan stabiliseren. Tot op heden is nog geen officieel goedgekeurde toepassing van psilocine voor neurodegeneratieve ziekten. De toekomstige toepassing zou er uit kunnen zien als een geïntegreerde aanpak: een combinatie van psilocybine-geassisteerde psychotherapie om stemming en neuroplasticiteit te verbeteren, mogelijk in microdosering of gemodificeerde vorm om de hallucinaties te beperken. Ook bestaan er initiatieven om chemische analogen van psilocine te ontwikkelen die de therapeutische effecten behouden maar minder psychedelisch zijn. Dit zou met name nuttig zijn voor ouderen met Alzheimer, waar een volledige psychedelische ervaring mogelijk belastend of verwarrend is. Ondanks de veelbelovende preklinische resultaten is meer onderzoek nodig: langdurige dierstudies om effecten op amyloïd- en tau-patronen in de hersenen te beoordelen, alsook klinische studies bij patiënten (eerst gericht op veiligheid en proof-of-concept). Pas dan kan men beoordelen of psilocine een plaats kan krijgen als (adjunctieve) therapie bij Alzheimer.
Bijwerkingen en risico’s: Psilocine (als psychedelisch middel) kent bekende bijwerkingen, die in het kader van neurodegeneratieve patiënten extra zorgvuldig afgewogen moeten worden. Over het algemeen is psilocybine in klinische onderzoeken goed verdraagbaar gebleken, met voornamelijk milde en voorbijgaande bijwerkingen. Vaak gerapporteerd zijn fysiologische effecten zoals verhoogde bloeddruk en hartslag, pupilverwijding, duizeligheid en soms hoofdpijn na inname. Tijdens de psychedelische ervaring zelf kunnen psychologische bijwerkingen optreden, waaronder angst, verwarring, of een onaangename “trip” als de setting niet optimaal is. Bij Alzheimer-patiënten, die mogelijk al verward of angstig kunnen zijn, is het risico op acute desoriëntatie en paniek daarom een belangrijk aandachtspunt. Rigide medische begeleiding en een veilige omgeving zijn noodzakelijk bij enig klinisch gebruik. Naast deze kortdurende effecten zijn er ook enkele zeldzame maar ernstige risico’s gerapporteerd (voornamelijk bij recreatief of onbegeleid gebruik van hoge doses). Voorbeelden hiervan zijn gevallen van takotsubo cardiomyopathie (een acute hartspierzwakte) na gebruik van hallucinogene paddenstoelen, ernstige rhabdomyolyse (spierschade) geassocieerd met psychedelica, het uitlokken van manische episodes bij personen met bipolaire aanleg, en incidenteel langdurige perceptiestoornissen (HPPD: hallucinogen persisting perception disorder). Hoewel deze complicaties zeldzaam zijn, benadrukken ze dat psilocine niet zonder meer risicoloos is, zeker niet in een kwetsbare populatie. Specifiek voor neurodegeneratieve patiënten geldt extra voorzichtigheid: comorbide gezondheidsproblemen (zoals cardiovasculaire aandoeningen) kunnen de tolerantie voor bloeddrukpieken verlagen, en polyfarmacie (meerdere medicijnen) kan onbekende interacties geven met psilocine. Verder sluiten klinische trials mensen met een voorgeschiedenis van psychose meestal uit, omdat serotonerge hallucinogenen een latent psychotisch beeld zouden kunnen verergeren. Toch laten tot nu toe de meeste gecontroleerde studies zien dat, mits goed gescreend en begeleid, ernstige bijwerkingen zeer ongebruikelijk zijn bij psilocybinegebruik. In het kader van Alzheimer zou waarschijnlijk ingezet worden op lagere doseringen of non-hallucinogene varianten om risico’s te minimaliseren. Huidige onderzoeken besteden ook aandacht aan methoden om de hallucinogene component af te zwakken zonder de therapeutische te verliezen. Samengevat zijn de voornaamste bijwerkingen van psilocine: acute psychedelische perceptuele verstoringen (inclusief potentieel angstige ervaringen), fysiologische stressrespons (verhoogde hartslag/bloeddruk), en zeldzamer ernstige reacties bij onbegeleid gebruik. Deze risico’s kunnen echter gemitigeerd worden door grondige screening, medische supervisie, juiste dosering en set/setting – factoren die in onderzoekssetting centraal staan.
Conclusie:
Psilocine en psilocybine vormen een nieuw onderzoeksgebied in de context van Alzheimer. De huidige wetenschappelijke literatuur toont voorzichtig optimisme dat deze stoffen neuroprotectieve eigenschappen hebben – variërend van het stimuleren van synaptische groei tot het dempen van schadelijke neuroinflammatie – die relevant zijn voor het tegengaan van AD-pathologie. Rechtstreekse impact op tau-eiwitaggregatie is nog niet overtuigend aangetoond, maar indirecte routes (zoals verhoogde BDNF, verminderde ontsteking) kunnen een positieve invloed op tau-pathologie uitoefenen. Theoretische mechanismen concentreren zich rond 5-HT_2A-receptoractivatie en de cascade aan cellulaire effecten die daaruit voortvloeit, waaronder genexpressieveranderingen ten gunste van neuronale overleving. Mogelijke therapeutische toepassingen in de toekomst omvatten zowel het behandelen van neuropsychiatrische symptomen bij dementie als het afremmen van neurodegeneratie zelf, zij het dat harde klinische bewijzen daarvoor nog ontbreken. Cruciaal is dat bij eventuele toepassing de balans wordt gevonden tussen werking en bijwerking – bijvoorbeeld door innovaties als microdosering of nieuwe analogen – zodat patiënten met Alzheimer kunnen profiteren van de neurobeschermende effecten zonder disproportionele risico’s. Verdere preklinische en klinische studies in de komende jaren zullen moeten uitwijzen in hoeverre psilocine een veilige en effectieve rol kan spelen in de strijd tegen Alzheimer.
Bronnen: Dit overzicht is gebaseerd op een synthese van recente reviews en studies, waaronder Frontiers in Neuroscience (2024), Frontiers in Synaptic Neuroscience (2020), Journal of Neurochemistry (2022), en experimenteel onderzoek gepubliceerd in o.a. Experimental Brain Research, Molecules, en Molecular Psychiatry. De tabel met onderzoeksresultaten refereert aan specifieke studies en trialregistraties (zie referenties in de tabel). Deze bronnen onderschrijven gezamenlijk het potentieel van psilocine/psilocybine als innovatieve benadering voor Alzheimer, terwijl ze tegelijk benadrukken dat verder onderzoek nodig is om de voorlopige bevindingen te valideren.