Psilocybine, het werkzame bestanddeel van paddo's en magische truffels, staat bekend als een psychedelische stof met diepe bewustzijnsverruimende effecten. Maar psilocybine doet veel meer dan alleen een 'trip' opwekken. De stof heeft ook krachtige biochemische eigenschappen die kunnen bijdragen aan een betere lichamelijke én mentale gezondheid — zelfs in afwezigheid van de subjectieve beleving.
In dit artikel bekijken we wat psilocybine doet op celniveau, en wat dat in theorie kan betekenen voor de behandeling of verlichting van uiteenlopende aandoeningen.
1. Ontstekingsremming in het brein en lichaam
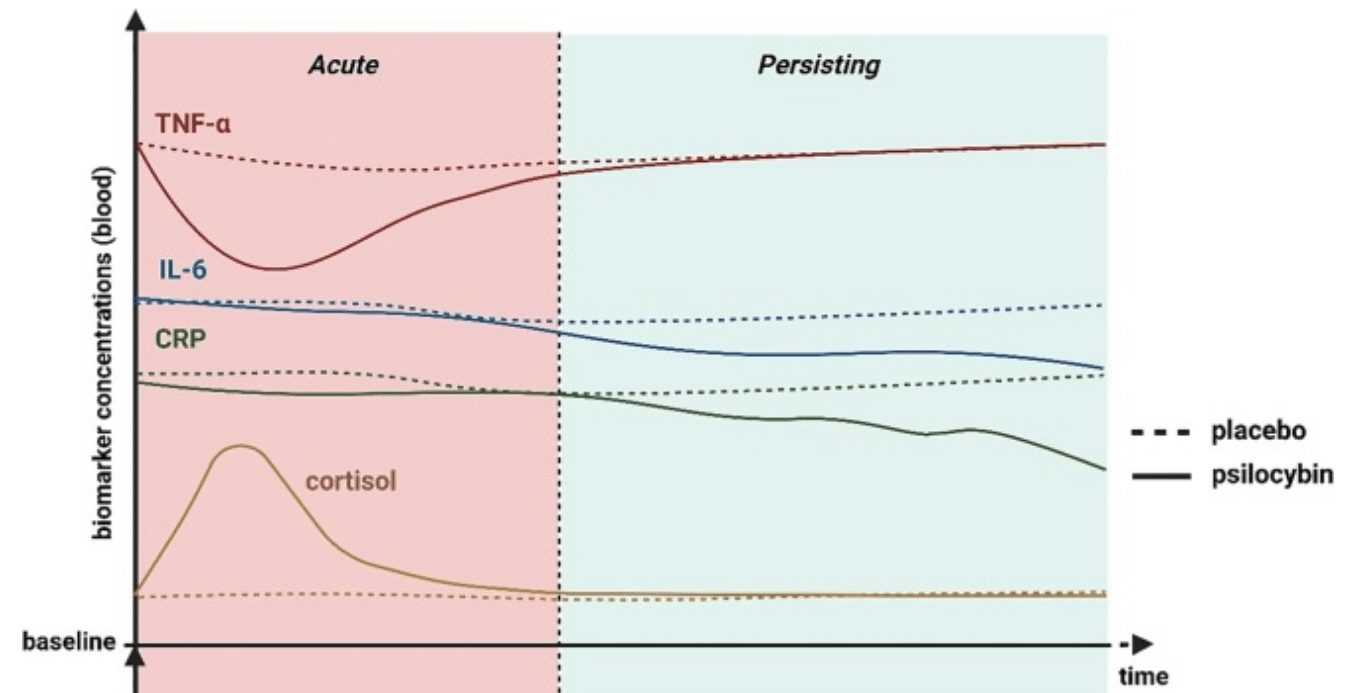
Uit recent onderzoek blijkt dat psilocybine de niveaus van ontstekingsbevorderende stoffen zoals TNF-α, IL-6 en CRP verlaagt — stoffen die vaak verhoogd zijn bij depressie, angst, chronische stress en neurodegeneratieve aandoeningen. Deze ontstekingsremmende werking is beschreven in het artikel:
🔗 Nieuwe werkingsmechanisme psilocybine ontdekt – ontstekingsremmer in het brein
Biochemisch mechanisme:
-
Psilocine (de actieve stof na omzetting van psilocybine) bindt aan 5-HT2A-receptoren op immuuncellen (waaronder meningeale monocyten).
-
Dit remt ontstekingsroutes via transcriptiefactoren zoals NF-κB.
-
Resultaat: verlaging van systemische én neuro-inflammatie.
In theorie positief bij:
-
Chronische ontstekingsziekten (bv. reuma, MS, ziekte van Crohn)
-
Depressie en angststoornissen (waarbij inflammatie als onderliggend mechanisme meespeelt)
-
Post-covid klachten met verhoogde ontstekingswaarden
-
Neurodegeneratieve ziekten zoals Alzheimer en Parkinson
Zie ook het artikel van Tripforum over deze koppeling tussen ontsteking en psychische klachten:
🔗 Psychedelica, ontsteking en het brein: nieuwe inzichten in angst en depressie
2. Stimulatie van neuroplasticiteit
Psilocybine verhoogt de afgifte van BDNF (Brain-Derived Neurotrophic Factor) en stimuleert glutamaatsignalering, wat leidt tot het vormen van nieuwe synaptische verbindingen in het brein — ook wel neuroplasticiteit genoemd.
🔗 Meer over neuroplasticiteit en psychedelica
Mechanisme:
-
5-HT2A-activatie → verhoogde CREB → verhoogde expressie van BDNF en mTOR
-
Dit leidt tot groei van dendrieten, axonale vertakkingen en synapsen
Mogelijke gezondheidsvoordelen:
-
Verbeterd leervermogen, geheugen en herstel na hersenletsel
-
Ondersteuning bij neurodegeneratie (MS, Alzheimer, Parkinson)
-
Herstel van verstoorde netwerken bij depressie, verslaving en trauma
3. Onderdrukking van oxidatieve stress en celveroudering
Psilocybine activeert enzymen zoals SIRT1, glutathion peroxidase (GPx) en superoxide dismutase (SOD), die samen oxidatieve stress verminderen en de mitochondriale functie verbeteren.
Wat doet SIRT1?
-
Herstelt DNA-schade
-
Verlengt telomeerlengte
-
Vermindert cellulaire senescentie
In theorie relevant bij:
-
Verouderingsprocessen
-
Aandoeningen met hoge oxidatieve belasting (zoals diabetes, hart- en vaatziekten)
-
Herstel na fysieke of mentale burn-out
-
Idiopathische pulmonale fibrose (IPF)
4. Positieve effecten op de alvleesklier en diabetes type 2
Hoewel nog experimenteel, zijn er aanwijzingen dat psilocybine de β-cellen in de alvleesklier (die insuline produceren) kan beschermen tegen schade bij diabetes type 2.
🔗 Welke positieve effecten heeft psilocybine op diabetes?
Belangrijke mechanismen:
-
Remming van TXNIP, een eiwit dat β-cellen beschadigt bij hoge glucose
-
Remming van apoptoseroutes via STAT1 en STAT3
-
Preventie van dedifferentiatie van bètacellen (waardoor ze hun functie behouden)
Implicatie:
-
Psilocybine zou in theorie kunnen bijdragen aan behoud van insulineproductie
-
Potentieel bruikbaar als aanvullende therapie bij metabool syndroom of prediabetes
5. Immunomodulatie via serotonerge routes
Immuuncellen zoals T-cellen en microglia bevatten serotonine-receptoren (met name 5-HT1A en 5-HT2A). Psilocybine beïnvloedt via deze receptoren het immuunsysteem.
Effecten:
-
Minder overactivatie van microglia (de ‘schoonmaakcellen’ van de hersenen)
-
Balans tussen pro- en anti-inflammatoire T-helpercellen
-
Onderdrukking van auto-immuunreacties
In theorie gunstig bij:
-
Auto-immuunziekten (zoals lupus, MS)
-
Neuro-inflammatie bij chronische stress
-
Hersenschade na trauma
Samenvattende tabel: wat kan psilocybine biochemisch betekenen?
| Werkingsmechanisme | Biochemische route | Mogelijke toepassingen |
|---|---|---|
| Ontstekingsremming | ↓ TNF-α, IL-6, CRP via NF-κB-inhibitie | Angst, depressie, post-COVID, MS |
| Neuroplasticiteit | ↑ BDNF, mTOR, glutamaat | Depressie, burn-out, Parkinson |
| Antioxidatie & verjonging | ↑ SIRT1, ↓ oxidatieve stress | Veroudering, IPF, celherstel |
| Bescherming β-cellen | ↓ TXNIP, ↓ STAT1/3, behoud insulinefunctie | Diabetes type 2, metabool syndroom |
| Immunomodulatie | 5-HT2A op T-cellen en microglia | Auto-immuunziekten, hersenontsteking |
Conclusie: een moleculair medicijn in de dop?
Hoewel psilocybine het meest bekend is als psychedelische stof, wijzen de wetenschappelijke data op brede biologische effecten op ontsteking, neuroplasticiteit, oxidatie, celdood en immuniteit. Deze effecten vinden plaats via bekende moleculaire routes en blijven niet beperkt tot de psyche — het lichaam zelf ondergaat ook meetbare veranderingen.
De therapeutische waarde van psilocybine reikt daarmee verder dan spirituele ervaringen of psychologische inzichten. Als regulator van celgezondheid en immuunbalans biedt psilocybine een veelbelovende invalshoek voor toekomstige medische toepassingen, al blijft grootschalig klinisch onderzoek noodzakelijk.
Serotonine 5-HT2A Receptor en Signaaltransductie
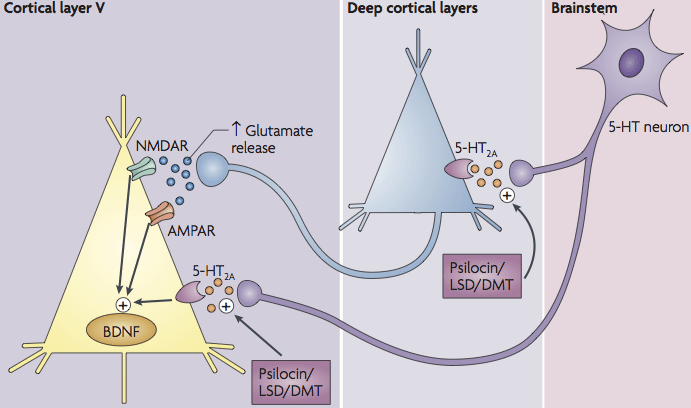
Psilocybine (via zijn actieve metaboliet psilocine) oefent zijn primaire werking uit als agonist van de serotonine 5-HT2A receptor in het brein. Dit G-proteïne-gekoppelde receptor (Gq) activeert bij stimulatie intracellulaire signaalroutes zoals fosfolipase C, wat leidt tot een toename van inositoltrifosfaat (IP₃) en calciumvrijzetting in neuronen. Deze cascade zet diverse kinases aan (bijv. PKC, MAP-kinasen), die genexpressie kunnen beïnvloeden en neuronale plasticiteit bevorderen. 5-HT2A-receptoren zijn rijkelijk aanwezig op corticale piramidecellen (m.n. in laag V van de prefrontale cortex) én op GABA-interneuronen. Activering van 5-HT2A in deze netwerken veroorzaakt uiteindelijk een verhoogde neuronale excitatie – deels door rechtstreekse stimulatie van glutamaterge piramidecellen, deels door disinhibitie (remming van lokale GABA-interneuronen). Het resultaat is een verhoogde corticale prikkeloverdracht en ontregeling van normale ritmes, wat geassocieerd wordt met de psychedelische bewustzijnsveranderingen. Klassiek onderzoek toonde bijvoorbeeld dat serotonine via 5-HT2A de exciterende postsynaptische stroom in prefrontale pyramidecellen vergroot door een asynchrone glutamaat-afgifte. Dit mechanisme ligt ten grondslag aan de acute sensorische en cognitieve effecten van psilocybine.
5-HT2A-activatie upreguleert onmiddellijk bepaalde genen (zogenaamde immediate early genes) betrokken bij plasticiteit. Zo is aangetoond dat psilocybine acuut de expressie van EGR1 verhoogt, een gen dat neurale groei en synapsvorming faciliteert. Verder speelt 5-HT2A een cruciale rol in downstream signaaltransductie naar neuroplastische routes: het triggert de vrijzetting van neurotransmitters en tweede boodschappers die bijvoorbeeld de aanmaak van neurotrofines aanwakkeren. Belangrijk is dat de hallucinogene effecten strikt 5-HT2A-afhankelijk zijn: in diermodellen wordt de typische head-twitch response (correlatie van hallucinaties) geblokkeerd door 5-HT2A-antagonisten. Psilocybine bindt ook in mindere mate aan andere serotonine-receptoren (zoals 5-HT1A), wat kan bijdragen aan anxiolyse en mood regulatie, maar de 5-HT2A-route domineert de unieke bewustzijnsverruimende werking.
Glutamaat en Neurotransmissie
Glutamaat is de voornaamste exciterende neurotransmitter in het centrale zenuwstelsel, en psilocybine beïnvloedt glutamaterge transmissie sterk via 5-HT2A-mechanismen. Activatie van 5-HT2A op glutamaterge pyramidecellen leidt tot verhoogde glutamaat-afgifte in corticale circuits. Dit veroorzaakt een cascade van excitatie in neurale netwerken en verhoogt de `neurale plasticiteit en informatieverwerking. Tegelijkertijd kan 5-HT2A-activering op inhiberende interneuronen de remming verlagen, wat een netto toename van glutamaterge signaling teweegbrengt. Studies ondersteunen dit: klassieke psychedelica veroorzaken een asynchrone, verhoogde glutamaatvrijzetting in de prefrontale cortex. Deze acute glutamaatgolf wordt in verband gebracht met de “gedesynchroniseerde” hersentoestand en verhoogde corticale connectiviteit onder psilocybine.
Interessant genoeg lijken de glutamaateffecten van psilocybine regio-specifiek en dynamisch. Een hoog-resolutie MRS (magnetische resonantie spectroscopie) studie toonde aan dat direct na toediening het glutamaatniveau in de hippocampus daalde, en die acute glutamaatdaling correleerde met een vermindering van TNF-α. Dit suggereert dat psilocybine mogelijk overmatige glutamaatsignalen tempert in stressgerelateerde geheugencentra (hippocampus), terwijl het elders juist prikkeloverdracht verhoogt. Bovendien kan verhoogde glutamaat-afgifte via de activatie van AMPA-receptoren downstream pathways in gang zetten die plasticiteit bevorderen. Bijvoorbeeld: 5-HT2A-gestimuleerde glutamaatvrijzetting activeert AMPA-receptoren, wat op zijn beurt de afgifte van brain-derived neurotrophic factor (BDNF) triggert en de TrkB-receptor signalering stimuleert. Aldus vormt glutamaat een cruciale schakel tussen de initiële receptoractivatie en de bredere cellulaire respons, waarbij het de verbinding legt tussen neurotransmissie en groeifactor-gedreven herstelmechanismen.
Neuroplasticiteit en Neurotrofines (BDNF, mTOR)
Neuroplasticiteit verwijst naar het vermogen van hersencellen om nieuwe verbindingen te vormen en structureel/functioneel te veranderen. Psilocybine blijkt sterke plastiteit-bevorderende eigenschappen te hebben. Zo verhogen klassieke psychedelica (psilocybine, LSD, DMT, etc.) de dendritische vertakking en dendritische spinedichtheid van neuronen in de prefrontale cortex, vergelijkbaar of zelfs sterker dan ketamine (een bekend snelwerkend antidepressivum). In kweekexperimenten en diermodellen stimuleren psychedelica de uitgroei van neurieten en de vorming van nieuwe synapsen, waardoor zij de naam “psychoplastogenen” hebben gekregen. Dit effect is direct gekoppeld aan bepaalde moleculaire groeisignalen.
Een belangrijke rol is weggelegd voor de neurotrofine BDNF (brain-derived neurotrophic factor) en zijn receptor TrkB. Psilocybine verhoogt de expressie en vrijzetting van BDNF, wat essentieel is voor synapsgroei en overleving van neuronen. Bij muizen is aangetoond dat één dosis psilocybine de door stress veroorzaakte daling in hippocampale BDNF-niveaus volledig tegengaat. Hierdoor werden structurele afwijkingen door fear conditioning (zoals minder dendriettakken en spines) voorkomen. Mechanistic target of rapamycin (mTOR), een centrale kinase in celgroei en synapsvorming, wordt daarbij eveneens geactiveerd: in dezelfde studie herstelde psilocybine de afname van mTOR-eiwit in de hippocampus veroorzaakt door traumatische stress. Dit wijst erop dat psilocybine de BDNF-TrkB-mTOR route aanzwengelt om neuroplasticiteit te bevorderen.
Cruciaal is dat deze plasticiteitseffecten afhankelijk zijn van BDNF/TrkB en mTOR. Experimenteel is vastgesteld dat psychedelica hun groei-stimulerende werking verliezen als de TrkB-receptor wordt geblokkeerd of als mTOR wordt geremd. Met andere woorden, psychedelisch-geïnduceerde synaptogenese vereist TrkB-activatie en mTOR-signalerings. Ook de 5-HT2A-receptor blijkt hierbij een noodzakelijke schakel: het blokkeren van 5-HT2A voorkomt de door psychedelica geïnduceerde neurietgroei en toename in spines. Deze drie factoren – 5-HT2A, BDNF-TrkB en mTOR – fungeren dus als een knooppunt voor neuroplasticiteit door psilocybine.
Opmerkelijk is dat recent onderzoek suggereert dat psilocine (de actieve metaboliet) mogelijk zelf direct TrkB-receptoren allosteer moduleren kan. In een studie bond psilocine met hoge affiniteit aan TrkB, waardoor BDNF-signalen werden versterkt. De hierdoor geïnduceerde neuroplastische en antidepressieve effecten traden onafhankelijk van 5-HT2A op, terwijl de psychedelische sensorische effecten (zoals hallucinaties) juist 5-HT2A-afhankelijk bleven. Dit duidt op een interessant dualistisch mechanisme: psilocybine kan via serotonerge weg acute bewustzijnsveranderingen teweegbrengen én via directe TrkB-activatie de langdurige neuronale herstelmechanismen ondersteunen. Uiteindelijk resulteren deze processen in verhoogde synaptische connectiviteit, verbetering van emotionele netwerkcircuits en potentieel langdurige therapeutische effecten (bijvoorbeeld antidepressieve resultaten) na slechts één of enkele doses.
Ontstekingsreacties en Immunomodulatie (TNF-α, IL-6, CRP, STAT1/3)
Er komt toenemende evidentie dat psilocybine ontstekingsreacties dempt en immunologische markers beïnvloedt, wat relevant is omdat veel psychiatrische aandoeningen gepaard gaan met chronische ontsteking. In een placebo-gecontroleerde studie met gezonde vrijwilligers bleek één dosis psilocybine acuut de circulerende spiegels van de pro-inflammatoire cytokine TNF-α significant te verlagen. Andere ontstekingsmarkers (zoals IL-6, IL-1β en het acute-fase-eiwit CRP) veranderden niet direct, maar toonden na een week opvallende dalingen: zeven dagen na psilocybinetoediening waren IL-6 en CRP blijvend lager vergeleken met placebo. Interessant genoeg correleerden sterkere dalingen in IL-6 en CRP met meer persisterende verbeteringen in stemming en sociaal functioneren van de deelnemers. Dit suggereert dat de anti-inflammatoire effecten van psilocybine mogelijk bijdragen aan de langdurige psychologische voordelen (zoals antidepressieve of anxiolytische effecten) die worden waargenomen.
De immunomodulerende werking van psilocybine wordt ondersteund door cellulaire studies. In humane macrofaag-modellen (THP-1 cellen) die met LPS endotoxine worden geactiveerd, onderdrukt psilocybine de ontstekingscascade. Met name werd gezien dat psilocybine de fosforylering (activering) van belangrijke transcriptiefactoren als NF-κB, STAT1 en STAT3 vermindert. Hierdoor nam de genexpressie van pro-inflammatoire mediatoren af: psilocybine verlaagde dose-afhankelijk de productie van cytokines zoals TNF-α en IL-1β in geprikkelde immuuncellen. Deze werking verloopt deels via remming van de IL-6/JAK2/STAT3-route, een centrale signaalweg in ontstekingsregulatie. Door het TYK2/STAT3-pad te dempen en tevens de activatie van STAT1 te beperken, voorkomt psilocybine de nucleaire transcriptie van diverse ontstekingsgenen. Samengevat wijst dit erop dat psilocybine als een ontstekingsremmer op cellulair niveau kan werken door sleutelroutes in de cytokineproductie te blokkeren.
Ook in het centrale zenuwstelsel zelf zijn immuuncellen doelwit van psilocine. Microglia, de immuunwachtposten van de hersenen, drukken eveneens 5-HT2-receptoren uit. In microglia-celmodellen bleek psilocine via deze receptoren reactieve microglia te temperen. Op niet-toxische concentraties had psilocine geen effect op de TNF-α afscheiding door geactiveerde microglia, maar het onderdrukte wel de fagocytaire activiteit en verlaagde de productie van reactive zuurstof- en stikstofradicalen (ROS en NO) significant. Twee selectieve 5-HT2A-agonisten bootsten deze effecten na, terwijl 5-HT2A-antagonisten ze blokkeerden, wat bevestigt dat deze microglia-modulatie 5-HT2-gedreven is. Dit betekent dat psilocybine een neuroprotectieve component kan hebben: door microgliale overactivatie en oxidatieve stress te verlagen, kan het indirect neuronale schade door ontsteking beperken. Over het geheel genomen ondersteunen deze bevindingen dat psilocybine niet alleen neuronen maar ook glia en immuunsystemen beïnvloedt, resulterend in verlaagde pro-inflammatoire signalen (TNF-α, IL-6, CRP) en mogelijk een gunstiger milieu voor hersenherstel.
Epigenetische Regulatie en Genexpressie (SIRT1, TXNIP, DNA-methylatie)
Naast acute receptor- en signaalroutes, kunnen psychedelica ook langdurige veranderingen in genexpressie en epigenetica teweegbrengen. Er zijn aanwijzingen dat psilocybine (en verwante middelen) bepaalde epigenetische mechanismen moduleert, hoewel dit onderzoeksveld nog pril is. Een voorbeeld is het effect op DNA-methylatie: langdurige therapeutische effecten zouden gedeeltelijk kunnen worden gedragen door veranderingen in methyleringspatronen van DNA in hersencellen. Recent is gerapporteerd dat LSD, een vergelijkbaar klassiek hallucinogeen, de DNA-methylatie in neurale weefsels verandert, wat resulteert in gewijzigde expressie van genen die betrokken zijn bij neurotrofische en plasticiteits-signaleringsroutes. Voor psilocybine zijn soortgelijke bevindingen gesuggereerd. In een preklinische studie bij muizen bleek dat het blijvende sociale gedragsbevorderende effect van psilocybine geblokkeerd kon worden door een inhibitor van DNA-methylatie, wat impliceert dat epigenetische aanpassingen (zoals methylering) vereist waren voor het consolideren van het effect. Hoewel concrete data bij de mens nog ontbreken, lopen er epigenome-wide association studies om te onderzoeken of psilocybine veranderingen in methylering in bloed of hersenweefsel veroorzaakt. Dergelijke epigenetische veranderingen zouden een biologische basis kunnen vormen voor de langdurige resets in stemming en cognitie die soms na psychedelische therapie gezien worden.
Ook op het niveau van histoneiwit-modificaties en enzymregulatie kunnen effecten optreden. Een belangrijk epigenetisch en metabool regel-eiwit is SIRT1 (sirtuin-1), een NAD+-afhankelijke histon-deacetylase. SIRT1 staat bekend om zijn anti-inflammatoire en neurobeschermende functies: het kan diverse transcriptiefactoren deacetyleren (inactiveren), waaronder NF-κB en p53, en zo oxidatieve stress en ontstekingsreacties dempen. Hoewel er tot op heden geen direct onderzoek is gepubliceerd naar psilocybine’s effect op SIRT1, is het denkbaar dat activering van SIRT1-pathways een rol speelt in de waargenomen ontstekingsremming en bevordering van cellulaire gezondheid door psilocybine. SIRT1 wordt namelijk geactiveerd onder omstandigheden van verminderde stress en verbeterd cellulair metabolisme, wat zou kunnen samenhangen met de normalisering van stressmarkers na psychedelisch gebruik. Toekomstig onderzoek moet uitwijzen of psilocybine de expressie of activiteit van sirtuïnes beïnvloedt – bijvoorbeeld via de toename in NAD+ spiegels of via downstream signaalroutes – wat bij zou dragen aan epigenetische modulatie van neuronale functies.
Een andere factor van interesse is TXNIP (thioredoxin-interacting protein), een eiwit dat fungeert als sensorkoppeling tussen cellulaire stress (zoals hoge ROS of glucosespiegels) en ontstekingsactivatie. TXNIP is een sleutelschakelaar die bij oxidatieve stress loslaat van thioredoxine en zo het NLRP3-inflammasoom activeert, wat tot cytokineproductie en celontsteking leidt. Chronische stress en depressie zijn geassocieerd met verhoogde TXNIP niveaus en overactivatie van inflammasomen. Er zijn nog geen publicaties die expliciet het effect van psilocybine op TXNIP hebben gemeten. Echter, gezien de eerdergenoemde afname in pro-inflammatoire cytokinen en ROS-productie onder psilocybine, valt te speculeren dat minder TXNIP-activatie plaatsvindt (aangezien TXNIP activatie vaak ROS-gedreven is). Met andere woorden, door oxidatieve stress en ontsteking te verminderen, zou psilocybine indirect de TXNIP-NLRP3 route kunnen afremmen, vergelijkbaar met wat is waargenomen bij andere anti-inflammatoire interventies. Dit blijft vooralsnog hypothetisch; toekomstige neuro-immunologische studies (bijvoorbeeld in diermodellen van neuro-inflammatie) moeten uitwijzen of psilocybine TXNIP expressie of inflammasoomactiviteit meetbaar verandert.
Al met al lijkt psilocybine ook op het niveau van genregulatie voor verschuivingen te zorgen die herstel bevorderen. Door acute triggers (zoals 5-HT2A-activatie, glutamaatgolf) worden transcriptiefactoren geactiveerd of juist geïnhibeerd, wat leidt tot verandering in genexpressieprofielen in neuronen en immuuncellen. Veel van deze genen coderen voor neurotrofines (BDNF), groeifactorreceptoren (TrkB), cytoskelet-eiwitten of ontstekingsmediatoren. Deze concert aan wijzigingen – potentieel geborgd door epigenetische markers (histon-modificaties, DNA-methylatie) – zou een ”herprogrammering” van neurale circuits kunnen ondersteunen die bijdraagt aan de langdurige effecten van psilocybine.
Rol van Psilocybine in het Centrale Zenuwstelsel
Psilocybine grijpt dus op meerdere niveaus in op de neurobiologie van het centrale zenuwstelsel. Primair werkt het als een potente serotonerge stimulator (via 5-HT2A) die acute veranderingen in neurotransmissie teweegbrengt – met name verhoogde glutamaatactiviteit in corticale netwerken – wat de bijzondere bewustzijnsverruiming en zintuiglijke effecten verklaart. Tegelijkertijd zet deze receptoractivatie een keten van signaaltransductie in gang die celgroei- en overlevingsroutes aanwakkert. Via het stimuleren van BDNF-productie en TrkB-receptoractivatie, en het activeren van mTOR, initieert psilocybine een cascade die leidt tot synaptogenese en dendritische groei. Dit resulteert in verhoogde connectiviteit en flexibiliteit van neurale netwerken – een fenomeen dat in verband wordt gebracht met de doorbraak van rigide negatieve gedachtepatronen en het “resetten” van pathologische breinfuncties bij depressie en andere aandoeningen.
Bovendien oefent psilocybine systemische en centrale anti-inflammatoire effecten uit. Door het dempen van pro-inflammatoire cytokines (zoals TNF-α, IL-6) en het moduleren van immuuncellen (microglia, macrofagen) creëert het een omgeving die neurogene herstelprocessen bevordert. Chronische ontsteking en stresshormoonontregeling (HPA-as hyperactiviteit) staan bekend als bevorderende factoren voor neuronale atrofie en psychiatrische symptomatologie; psilocybine’s normaliserende invloed hierop kan dus direct gelinkt zijn aan zijn therapeutisch potentieel.
Tot slot wijzen de (voorlopige) bevindingen over epigenetica en genexpressie erop dat psilocybine mogelijk blijvende moleculaire veranderingen aanzet die het brein in een veerkrachtiger staat brengen. Het zou bepaalde genprogramma’s kunnen “herkalibreren” – bijvoorbeeld door neurotrofine-genen te activeren en ontstekingsgenen te dempen – en deze veranderingen via epigenetische markers (zoals DNA-methylatie) langer laten doorwerken. Dergelijke mechanismen zouden verklaren hoe een enkele of beperkt aantal doses psilocybine langdurige gedrags- en stemmingsveranderingen kan induceren. Hoewel veel van deze routes nog nader onderzocht moeten worden, schetst huidig bewijs een beeld van psilocybine als een pleiotrope stof die neurale circuits herstructureert, neurochemische balans herstelt en het cellulaire milieu in het CNS optimaliseert. Deze unieke combinatie van effecten – op neuroplasticiteit, neurotransmissie, immunomodulatie en mogelijk epigenetische “reset” – vormt de neurobiologische basis voor de veelbelovende resultaten die met psilocybine-interventies worden gezien in klinische research.
Conclusie: Psilocybine werkt in op diverse moleculaire routes in de hersenen. Via 5-HT2A-gekoppelde signaaltransductie beïnvloedt het direct de neurotransmitterafgifte (vooral glutamaat) en zet het cellulaire groeiprocessen aan. Het verhoogt neurotrofines zoals BDNF en activeert het mTOR-pathway, wat leidt tot synaptische versterking en neuroplasticiteit. Daarnaast moduleert het immuunsysteem door ontstekingsmarkers als TNF-α, IL-6 en CRP te verlagen en transcriptiefactoren als STAT3/STAT1 en NF-κB te onderdrukken. Mogelijk draagt het ook bij aan epigenetische herprogrammering van neuronale genexpressie, onder meer via routes waarbij enzymen als SIRT1 en mediatoren als TXNIP betrokken zijn (hoewel dit nog niet definitief is aangetoond). Gezamenlijk ondersteunen deze mechanismen de neuroplasticiteit, neurotransmissie en ontstekingsremming in het centraal zenuwstelsel, waardoor psilocybine een uniek therapeutisch profiel heeft met potentieel blijvende positieve effecten op breinfunctie en psychisch welzijn.
Referenties
- Mason NL et al. (2023) – Brain Behav Immun, onderzoek naar psilocybine’s effecten op immuunmarkers (TNF-α, IL-6, CRP) bij gezonde vrijwilligers.
- Du Y et al. (2023) – Chin Med J, muisstudie die aantoont dat psilocybine via BDNF- en mTOR-signaleringsroutes neuroplasticiteit bevordert en stress-geïnduceerde neurodaling herstelt.
- Ly C et al. (2018) – Cell Reports, preklinisch bewijs dat psychedelica (incl. psilocine) snelle structurele plasticiteit induceren; vereisen 5-HT2A-activatie, TrkB (BDNF-receptor) en mTOR.
- Castrén E et al. (2023) – Nature Neuroscience, ontdekking dat psilocine direct aan TrkB bindt en BDNF-signalen versterkt; plasticiteit en antidepressief gedrag door psychedelica bleken afhankelijk van TrkB/BDNF en onafhankelijk van 5-HT2A.
- Wiens KR et al. (2024) – Molecules, studie in microglia-cellen waarin psilocine via 5-HT2A-receptoren fagocytose, ROS- en NO-productie door geactiveerde microglia onderdrukt (neuro-inflammatoire modulatie).
- Ghasemi Gojani E et al. (2024) – Psychoactives (MDPI), in-vitro ontstekingsmodel: psilocybine remt LPS-geïnduceerde ontsteking in macrofagen via afname van fosfo-NF-κB, STAT1 en STAT3, en bijbehorende daling van cytokine-expressie.
- Raval NP et al. (2023) – Front. Immunol., review over SIRT1 in ontstekingsregulatie; belicht SIRT1’s anti-inflammatoire werking door deacetylatie van histonen en ontstekingsfactoren.
- Shen X et al. (2018) – Nat. Rev. Cancer, beschrijft TXNIP als sleutelmolecule die cellulaire stress koppelt aan NLRP3-inflammasoom activatie. (Indirect relevant voor psilocybine’s ontstekingsremmende effect.)
- Dakic V et al. (2021) – Transl Psychiatry, toonde epigenetische veranderingen (DNA-methylatie, genexpressie) na LSD-behandeling, met impact op neuroplasticiteitsgenen. (Verwante bevinding, mogelijk analoog voor psilocybine.)