Maak psilocybine je DNA jonger?
Ja, er zijn sterke aanwijzingen dat psilocybine je DNA op cellulair niveau “jonger” kan maken, aldus het artikel psilocybine en telomeerlengte. In dat artikel wordt uitgebreid ingegaan op hoe psilocybine – of beter gezegd, de actieve stof psilocine – cellen langer laat leven en beschermt tegen de typische tekenen van veroudering, zoals verkorting van telomeren en oxidatieve schade.
Telomeren zijn de beschermende uiteinden van je DNA-strengen. Elke keer dat een cel zich deelt, worden deze iets korter, en wanneer ze te kort worden, stopt de cel met delen of sterft. Psilocybine blijkt dit slijtageproces te kunnen vertragen. In een studie uit 2025 bleef de telomeerlengte bij cellen die behandeld waren met psilocine vrijwel stabiel, terwijl ze bij de controlegroep aanzienlijk korter werden. Tegelijkertijd verhoogde psilocybine de activiteit van het enzym SIRT1, dat o.a. DNA-herstel stimuleert, telomerase activeert en ontstekingen onderdrukt. Zeker in combinatie met een gezonde leefstijl kan een psilocybine sessie bijdragen aan celverjonging en vertraging van biologische veroudering.
Wil je psilocybine inzetten met verjonging als doel, dan adviseert Triptherapie om vooraf een intake te doen. Zo krijg je gepersonaliseerd advies, inclusief mogelijke toevoegingen zoals fisetine of NAD+-boosters die het effect op DNA en celgezondheid kunnen versterken.
Zie ook:
Neurale gezondheid en neurogenese
Onderzoek suggereert dat psilocybine positieve effecten kan hebben op de neurale gezondheid door het bevorderen van neuroplasticiteit en mogelijk neurogenese. In een muismodel van posttraumatische stress (vreesconditionering) herstelde een enkele dosis psilocybine (2,5 mg/kg) de groei van nieuwe zenuwcellen in de hippocampus: het aantal jonge neuron-markers (DCX+, BrdU+) nam toe vergeleken met onbehandelde dieren. Tevens verminderde psilocybine bij deze muizen de stressreactie (minder “freezing” gedrag) en herstelde het verlaagde niveaus van BDNF (brain-derived neurotrophic factor) en mTOR tot normaal. Dit wijst erop dat psilocybine onder stressomstandigheden neuronale groei en herstel kan bevorderen, wat direct wijst op neurogene effecten (bij dieren).
Toch blijkt de dosis cruciaal. Een eerdere studie in muizen zag bij een zeer lage dosis (0,1 mg/kg) een kleine toename in nieuwe neuronen, maar hogere doses (0,5–1 mg/kg) verlaagden juist de overleving van nieuwe hersencellen. Dit negatieve effect bij hoge doses werd geblokkeerd door een serotonine-receptorantagonist (ketanserine), wat aangeeft dat de werking via 5-HT-receptoren verloopt. De neurogenese-bevorderende effecten van psilocybine zijn dus direct aangetoond in dierstudies, maar afhankelijk van de dosis en context. Bij mensen is directe hippocampale neurogenese moeilijk meetbaar; wel suggereren klinische bevindingen indirect dat psilocybine de hersenen “flexibeler” maakt. Zo werd bij patiënten met depressie na psilocybine-therapie een toename in cognitieve flexibiliteit en neurale connectiviteit gemeten, wat wijst op verbeterde hersenfunctie en plasticiteit. Dit zijn indirecte tekenen van “verjonging” van neurale netwerken, al is direct bewijs voor humane neurogenese nog beperkt.
Cellulaire veroudering (senescentie, oxidatieve stress, mitochondriën)
Recente laboratoriumstudies leveren eerste directe aanwijzingen dat psilocybine celveroudering kan vertragen. In een in-vitro model van cellulaire veroudering (menselijke fibroblasten) bleek continue blootstelling aan psilocybine de veroudering te vertragen: markers van celsenescentie namen af en de celdelingscapaciteit nam significant toe. Concreet verlaagde psilocybine de expressie van celcyclus-remmers (p16^INK4a^, p21) en de secretie van ontstekingsfactoren door verouderde cellen (het zogeheten SASP, senescence-associated secretory phenotype). Tegelijk steeg de activiteit van DNA-reparatie en proliferatie markers (zoals PCNA). Ook werd minder oxidatieve stress gemeten in behandelde cellen, wat duidt op betere mitochondriale functie en minder accumulatie van schadelijke reactieve zuurstofverbindingen. Deze resultaten zijn direct (in cellen) en suggereren dat psilocybine een anti-verouderingseffect op cellulair niveau heeft. Belangrijk is dat dit een enkelvoudige cellijn-studie betreft; aanvullende experimenten (bijv. in verschillende celtypen of weefsels) zijn nodig om de breedte van dit effect te bevestigen.
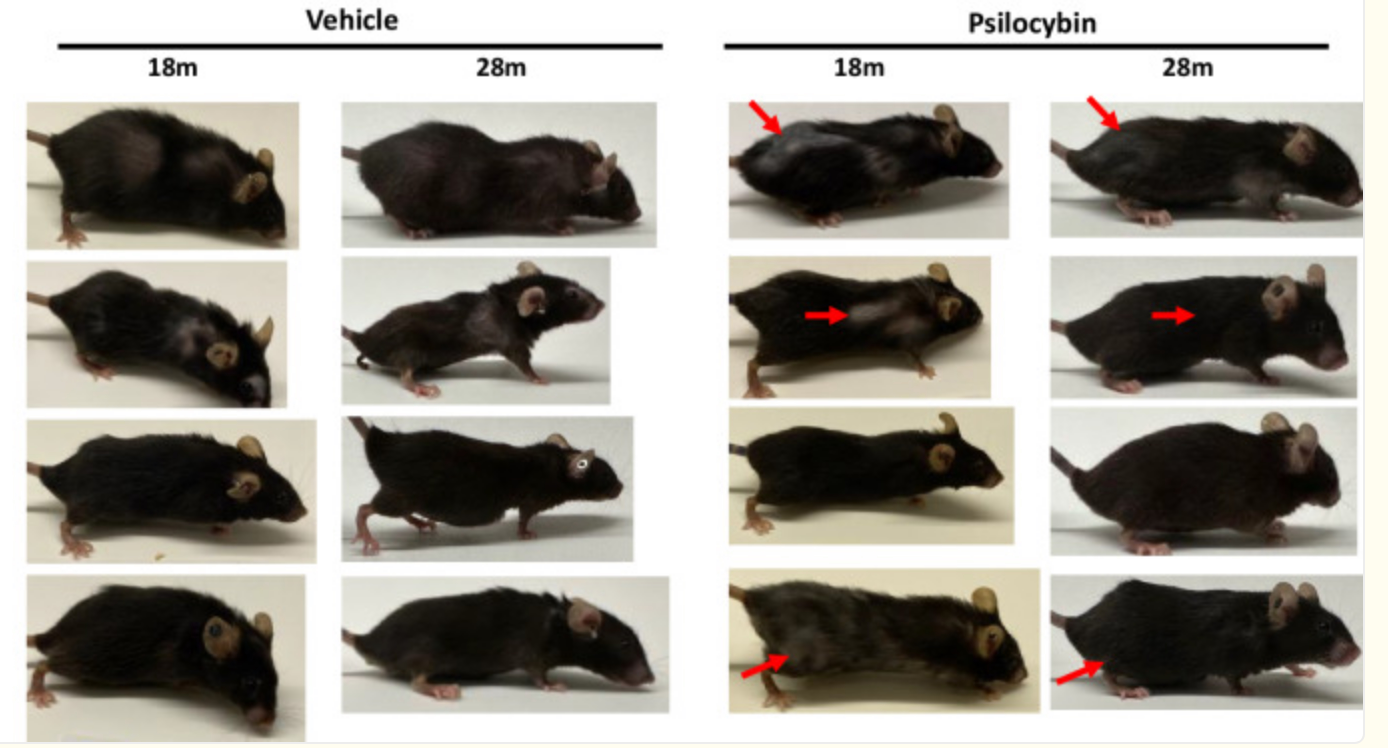
Daarnaast is er voorzichtig bewijs uit dieronderzoek. In een recente studie met oudere muizen (circa 60 “mensenjaren” oud) verlengde psilocybine-behandeling de levensduur en verbeterde fysieke ouderdomskenmerken. Muizen die gedurende 10 maanden maandelijks psilocybine kregen, hadden een overlevingspercentage van 80% tegen 50% in de controlegroep, en opmerkelijk genoeg groeiden kale plekken weer dicht en kregen grijzende vachtplekken hun pigment terug. Deze verjonging van de vacht wijst op celherstel in huid/haar. Hoewel dit indrukwekkend is, moet worden opgemerkt dat de toegepaste doses bij muizen relatief hoog waren en de vertaling naar mensen onzeker is. Samengevat zijn de aanwijzingen voor een celverjongend effect van psilocybine bemoedigend maar hoofdzakelijk beperkt tot celculturen en diermodellen; humane bevestiging ontbreekt nog.
Telomeerlengte en telomerase-activiteit
Telomeren, de beschermende DNA-eindstukken van chromosomen, verkorten bij elke celdeling en dienen als een moleculaire “klok” voor veroudering. Er bestaat een hypothese dat psilocybine deze klok kan vertragen door telomeerverkorting tegen te gaan. Deze “psilocybine-telomeer hypothese” wordt ondersteund door het gegeven dat verbeterde mentale gezondheid vaak samengaat met langere telomeren, terwijl chronische stress en depressie geassocieerd zijn met versnelde telomeerverkorting. Psilocybine kan sterke positieve effecten hebben op mentale gezondheid (zoals vermindering van angst en depressie), dus men veronderstelde dat het indirect ook telomeerlengte zou kunnen behouden of verlengen.
Recent labonderzoek biedt eerste directe evidentie voor invloed op telomeren. In de eerder genoemde celstudie bleken menselijke long- en huidfibroblasten die onder invloed van psilocybine verouderden, geen significante telomeerverkorting te vertonen vergeleken met onbehandelde verouderde cellen. Met andere woorden: psilocybine-behandelde cellen behielden telomeerlengtes vergelijkbaar met jonge controlecellen, terwijl in normale verouderde cellen de telomeren duidelijk waren ingekort. Dit wijst erop dat psilocybine de telomeerintegriteit kan beschermen. Over de rol van telomerase (het enzym dat telomeren verlengt) is nog niets direct gerapporteerd in deze context, maar het behoud van telomeerlengte suggereert dat psilocybine óf telomerase-activiteit verhoogt, óf de snelheid van telomeerafbraak verlaagt. Gezien het vroege stadium van dit onderzoek is het bewijs hier vooralsnog matig: we hebben overtuigend celmodel-resultaat, maar er zijn nog geen klinische studies die telomeerlengte bij psilocybinegebruikers hebben gemeten. Toekomstig onderzoek (bijvoorbeeld telomeermetingen bij deelnemers van psilocybine-therapiestudies) is nodig om deze belofte bij de mens te toetsen.
Inflammatie en immuunrespons
Psilocybine blijkt niet alleen in de hersenen, maar ook in het immuunsysteem effecten te sorteren – met potentieel ontstekingsremmende resultaten. In een placebo-gecontroleerde studie met gezonde vrijwilligers verlaagde een enkele matige dosis psilocybine acuut het niveau van de pro-inflammatoire cytokine TNF-α (tumor necrose factor alpha) in het bloed. Hoewel andere ontstekingsmarkers (zoals IL-1β, IL-6 en C-reactief proteïne) onmiddellijk na inname nog niet veranderden, was er zeven dagen later een opvallend effect: de spiegels van IL-6 en CRP waren significant gedaald ten opzichte van de placebogroep. Dit duidt op een blijvende immunomodulerende werking van psilocybine. Interessant genoeg gingen sterkere dalingen in IL-6 en CRP samen met betere stemming en sociale functioneren bij de proefpersonen een week na de sessie. Deze menselijke data (n=30 psilocybine vs 30 placebo) leveren direct bewijs dat psilocybine het immuunsysteem positief bijstuurt, zij het uit een relatief kleine studie.
Preklinische experimenten bevestigen dit beeld van ontstekingsremming. In een 3D-weefselmodel en immuuncelproeven werd gevonden dat psilocybine en zijn metaboliet psilocine de afgifte van meerdere pro-inflammatoire mediatoren onderdrukken. Zo verminderde psilocybine significant de productie van TNF-α en IFN-γ (interferon-gamma), evenals van cytokinen IL-6 en IL-8, die betrokken zijn bij ontstekingsreacties. Bovendien zijn er aanwijzingen dat psilocine microglia (de immuuncellen van de hersenen) gunstig beïnvloedt: het kan een overactieve, ontstekingsbevorderende microglia-status afremmen en zelfs voorkomen dat microglia gezonde neuronen opruimen (fagocyteren) in een ontstekingsmodel. Dit alles wijst erop dat psilocybine indirect anti-verouderingseffecten zou kunnen hebben via reductie van chronische ontsteking, aangezien laaggradige ontsteking (“inflammaging”) een bekende factor is bij verouderingsziekten. De bewijskracht is hier matig tot sterk: we hebben een gecontroleerde human study voor acute effecten en meerdere ondersteunende labstudies. Het mechanisme lijkt (deels) te lopen via serotonine-receptoren op immuuncellen die ontstekingsroutes dempen. Verdere klinische research (bijvoorbeeld in patiënten met inflammatoire aandoeningen) zal moeten uitwijzen of psilocybine therapeutisch ingezet kan worden om ontsteking en daarmee samenhangende verouderingsprocessen te remmen.
Regulatie van SIRT1 en andere verouderingsgenen/-eiwitten
Een opvallende bevinding is dat psilocybine invloed uitoefent op genen en eiwitten die geassocieerd zijn met levensduurregulatie. In cellulaire verouderingsmodellen leidde psilocybine tot een verhoogde expressie van het enzym SIRT1 (sirtuïne-1), een eiwit dat bekend staat als bevorderaar van levensduur en celgezondheid. SIRT1 speelt een sleutelrol in DNA-herstel, metabolisme en stressrespons van cellen. In psilocybine-behandelde cellen steeg het SIRT1-niveau significant, terwijl in verouderende controlecellen SIRT1 laag bleef. Tegelijk zag men een daling van GADD45a, een gen dat geactiveerd wordt door DNA-schade, wat suggereert dat er minder DNA-schade of betere reparatie plaatsvond in aanwezigheid of gevolg van psilocybine. Ook nam de hoeveelheid Nox4 (een enzym dat reactieve zuurstof produceert) af, terwijl Nrf2 (een transcriptiefactor die antioxidatieve genen aanzet) omhoog ging. Deze veranderingen vormen een patroon: psilocybine lijkt cellulair het pro-survival programma aan te zetten dat ook geactiveerd wordt bij calorische restrictie of door stoffen als resveratrol (die ook sirtuïnes activeren). Het activeren van SIRT1 en verhogen van Nrf2 wijst op een direct effect op epigenetische en stress-respons routes die veroudering bepalen.
Naast SIRT1 zijn er mogelijk andere gerelateerde targets. Bijvoorbeeld suggereren sommige onderzoekers dat psilocybine via de HPA-as (stress-as) en glucocorticoïden receptoren genexpressie beïnvloedt, vergelijkbaar met wat bij langdurige meditatie wordt gezien. Hoewel dit nog hypothetisch is, ondersteunt het idee dat psilocybine breed op verouderingsroutes ingrijpt. Omdat de harde data momenteel grotendeels van één celonderzoek afkomstig zijn, achten we de bewijskracht beperkt maar intrigerend. Dat onderzoek biedt direct bewijs dat psilocybine cellulaire “longevity genen” gunstig beïnvloedt, maar bevestiging in vivo (bij dieren of mensen) ontbreekt nog. Toch is dit een veelbelovend mechanisme: activatie van SIRT1 en verwante routes kan een verklaring vormen voor de uiteenlopende gezondheidsvoordelen die bij psilocybine-therapie worden gezien. Verdere studie moet uitwijzen of deze genregulatie ook optreedt bij doseringen en toedieningsschema’s die in klinische context gebruikt worden.
BDNF (Brain-Derived Neurotrophic Factor)
BDNF is een groeifactor in de hersenen die cruciaal is voor neuronoverleving, groei en synaptische plasticiteit. Er is groeiend bewijs dat psilocybine de BDNF-signaleringsroutes activeert en versterkt, hetgeen bijdraagt aan zowel antidepressieve als potentiële anti-verouderingseffecten in het brein. In dierstudies is bijvoorbeeld aangetoond dat psilocybine de negatieve impact van chronische stress op BDNF kan omkeren: bij angstige muizen herstelde een enkele psilocybine-dose de door stress verlaagde BDNF-expressie in de hippocampus. Dit ging gepaard met gedragsmatig herstel (minder depressief-/anhedonisch gedrag) en toegenomen neuronale vertakkingen, wat de rol van BDNF bij psilocybine’s effecten onderstreept.
Op cellulair niveau werkt psilocybine via de 5-HT2A serotoninereceptor, die een cascade activeert die BDNF-afgifte en -werking bevordert. Uit in-vitro onderzoek met zenuwcellen blijkt dat 5-HT2A-agonisten (zoals psilocybine/psilocine) de TrkB-receptor, waaraan BDNF bindt, activeren en zo groeiprocessen in gang zetten. Opmerkelijk is een recente ontdekking dat psilocine zelf direct aan de TrkB-receptor kan binden als een positieve allosterische modulator. Dit betekent dat psilocine de BDNF-receptor zó beïnvloedt dat BDNF zelf effectiever kan binden en signaleren. Moliner et al. (2023) toonden aan dat psilocine via deze route de downstream effecten van BDNF versterkt, leidend tot meer dendrietgroei en synapsvorming. Het gevolg is verbeterde neuronale overleving en connectiviteit. Indirect bewijs bij muizen ondersteunt dit: LSD, een verwante psychedelicum, verhoogt de lange-termijn overleving van nieuwe hippocampusneuronen via TrkB-activatie – een mechanisme dat ook voor psilocine is gesuggereerd.
Kortom, psilocybine verhoogt BDNF-niveaus en -werking in de hersenen, wat kan bijdragen aan neuronherstel en cognitieve functie. Dit effect is waarschijnlijk cruciaal voor de therapeutische impact (zoals antidepressie) en mogelijk voor neuroprotectie tegen veroudering. De bewijskracht is hier redelijk sterk in preklinische zin: meerdere dierstudies en celmodellen bevestigen betrokkenheid van BDNF. Bij mensen is direct meten van BDNF in de hersenen lastig, maar enkele studies hebben verhoogde BDNF in bloed of verbeterde cognitieve flexibiliteit (waar BDNF een rol in speelt) na psilocybine-gerapporteerd. Het indirecte bewijs bij mensen is dus in lijn met de preklinische bevindingen. Al met al lijkt BDNF-regulatie een belangrijk mechanisme waardoor psilocybine bijdraagt aan hersenverjonging en herstel.
Glutamaatregulatie en synaptische plasticiteit
Glutamaat is de voornaamste prikkelende neurotransmitter in de hersenen en speelt een grote rol in synaptische plasticiteit (het vermogen van synapsen om te versterken of verzwakken). Psychedelica, waaronder psilocybine, beïnvloeden de glutamaathuishouding, wat leidt tot structurele en functionele veranderingen in neurale netwerken. Zo is bekend dat activatie van 5-HT2A-receptoren op diepte-neuronen glutamaat-afgifte kan stimuleren in de prefrontale cortex, wat een cascade van synapsvorming in gang zet. Dit mechanisme is vergelijkbaar met dat van ketamine (een ander stof die plasticiteit bevordert), zij het via een andere receptor. Het netto-effect is het aanwakkeren van synaptische plasticiteit: er ontstaan nieuwe verbindingen tussen zenuwcellen en bestaande synapsen worden versterkt.
Sterk bewijs voor deze synaps-vernieuwende werking komt uit dierstudies. In een experiment met varkens (een model dat qua hersenstructuur dichter bij de mens ligt) verhoogde een eenmalige psilocybine-toediening meetbaar het aantal synapsen in de hersenen. Eén dag na injectie was de dichtheid van synaptisch vesikel eiwit 2A (SV2A) – een merker voor synapsen – in de hippocampus ~4,4% hoger dan bij controle, en na één week was de synapsdichtheid nog verder verhoogd (+9,2% in hippocampus, +6,1% in prefrontale cortex). Deze toename in SV2A-binding duidt op nieuw gevormde synapsen die persistent aanwezig bleven, wat een vorm van structurele “verjonging” van het brein weerspiegelt. Overigens bleek tegelijkertijd dat psilocybine acuut de dichtheid van 5-HT2A-receptoren verlaagde (downregulatie) – een waarschijnlijk feedbackmechanisme – maar na een week was die receptoradaptatie weer genormaliseerd. De blijvende synapswinst was echter opvallend en ondersteunt het idee dat psilocybine de hersenen in een meer jeugdige, plastische staat kan brengen.
Daarnaast zijn er functionele aanwijzingen voor glutamaatregulatie door psilocybine bij mensen. Uit een 7-Tesla MRS (magnetische resonantie spectroscopie) studie bleek dat direct na psilocybine-inname de glutamaatconcentratie in de hippocampus daalde. Interessant genoeg correleerde deze acute glutamaatdaling met de mate van TNF-α afname in het bloed, wat suggereert dat verminderde neuronale prikkeling hand in hand ging met een kalmering van de immuunactiviteit. Na een week normaliseerde de glutamaatwaarde weer. In een ander onderzoek werd een week na psilocybine-therapie een verlaging van glutamaat gemeten in de anterior cingulate cortex (ACC) van depressieve patiënten, samen met toegenomen functionele connectiviteit tussen hersennetwerken. Dit wijst erop dat psilocybine een reset geeft: eerst een acute ontregeling (desynchronisatie) van vaste netwerken en glutamaterge signalen, gevolgd door een herintegratie met nieuwe synaptische verbindingen. De netto uitkomst is een flexibeler neuraal netwerk – iets wat men zou kunnen beschouwen als een meer “jeugdig” breinprofiel, omdat bij jonge mensen synaptische connectiviteit en hersendynamiek hoger zijn.
De bewijskracht voor glutamaatgemedieerde synaptische plasticiteit door psilocybine is hoog in preklinische context (duidelijke neuronstructuur-veranderingen in dieren) en redelijk bij mensen (neurochemische en connectiviteitsveranderingen gemeten, zij het in kleine proefgroepen). Deze resultaten ondersteunen sterk het idee dat psilocybine direct bijdraagt aan hersenplasticiteit, wat essentieel is voor zowel herstel van functie als mogelijk vertraging van leeftijd-gerelateerde cognitieve achteruitgang.
Gedragsveranderingen en cognitieve/psychologische verjonging
Naast cellulaire en moleculaire effecten zien we bij psilocybine ook gedragsmatige en cognitieve veranderingen die doen denken aan een verjonging van de geest. Een kenmerk van ouder worden (of langbestaande depressie) is vaak cognitieve rigiditeit: minder flexibel denken en aanpassen. Studies tonen aan dat psilocybine dit kan tegengaan. In een open-label klinische studie met depressieve patiënten verbeterde psilocybine-ondersteunde therapie de cognitieve flexibiliteit significant – gemeten als minder perseveratiefouten in een set-shifting taak – en dit effect hield ten minste 4 weken aan. Deze verbetering trad op naast stemmingsverbetering, maar was er niet één-op-één mee gecorreleerd (suggereert dat het een afzonderlijk positief effect is). Het toegenomen vermogen om van gedachtepatroon te wisselen is vergelijkbaar met dat van jongere, gezonde personen, wat geïnterpreteerd kan worden als een psychologisch verjongend effect. Ook bij gezonde individuen zijn soortgelijke observaties gedaan: na een enkele hoge dosis psilocybine rapporteerden proefpersonen nog maanden later verhoogde openheid van denken en creativiteit, wat ongebruikelijk is omdat persoonlijkheid normaal stabiel is na de jongvolwassenheid. Dit soort veranderingen – meer openheid, cognitieve soepelheid, nieuwsgierigheid – zijn eigenschappen die men eerder bij jongere mensen ziet, en die bij veroudering of chronische stress vaak afnemen.
Epidemiologisch onderzoek levert aanvullend, zij het indirect, bewijs. Uit gegevens van een grote cohortstudie in de VS (MIDUS) bleek dat oudere volwassenen die ooit psychedelica hebben gebruikt gemiddeld beter presteerden op executieve functies en minder depressieve symptomen hadden dan hun leeftijdsgenoten die nooit psychedelica gebruikten. Er was echter geen verschil in zuivere geheugentests (episodisch geheugen). Hoewel dit observationeel is en causale conclusies lastig zijn (misschien waren gezondere, innovatievere mensen eerder geneigd psychedelica te proberen), past het beeld bij klinische bevindingen: psychedelisch gebruik correleert met beter behoud van cognitieve functies op latere leeftijd.
Wat betreft psychologisch welbevinden: psilocybine-therapie gaat vaak gepaard met een sterke en blijvende vermindering van negatieve gemoedstoestanden zoals depressie, angst en existentiële distress (bijvoorbeeld in palliatieve zorg). In trials met kankerpatiënten zagen onderzoekers dat één psilocybine-sessie nog na 6 maanden voor drastisch minder angst en een hoger gevoel van levenskwaliteit zorgde, iets wat men zou kunnen omschrijven als het terugbrengen van een jeugdige levenslust en mentale veerkracht. Bovendien beschouwt ~70% van de deelnemers hun psilocybine-ervaring als een van de meest persoonlijk betekenisvolle gebeurtenissen in hun leven (vergelijkbaar met de geboorte van een kind). Zulke transformerende ervaringen gaan vaak gepaard met positieve gedragsveranderingen – meer sociale verbondenheid, levensdoel en optimisme – wat doet denken aan een “reset” van vastgeroeste, leeftijd-gerelateerde negatieve denkpatronen.
Bewijskracht en interpretatie: de gedragsmatige tekenen van cognitieve/psychologische verjonging zijn veelal indirect en afkomstig uit kleinschalige studies of correlaties. Het is duidelijk dat psilocybine krachtige en duurzame psychologische effecten kan hebben (sterk bewijs voor antidepressie en angstvermindering). Dat deze effecten neigen in de richting van een meer jeugdige cognitieve toestand (meer flexibiliteit, openheid, levenslust) is een plausibele interpretatie, maar het vereist verdere research om dit specifiek als “verjonging” te bestempelen. Niettemin suggereren de huidige data dat psilocybine-gebruikers – althans tijdelijk of middels therapie – cognitief scherper en emotioneler veerkrachtiger kunnen worden. Dit draagt bij aan de idee dat psilocybine niet enkel symptomen bestrijdt, maar het fundamentele functioneren van de hersenen en psyche optimaliseert op een manier die overeenkomt met het terugdraaien van bepaalde ouderdomsgerelateerde veranderingen.
Conclusie
Samenvattend: Psilocybine, het werkzame bestanddeel van “magische” paddenstoelen, toont in vroege studies veelzijdige effecten op processen die gerelateerd zijn aan veroudering en celverjonging. Tabelmatig kunnen we stellen: het bevordert neurale groei en plasticiteit (aangetoond in dieren, vermoed in mensen); het vertraagt cellulaire verouderingsmarkers en behoudt telomeren (getoond in humane cellijnen en muizen); het vermindert ontstekingsfactoren en moduleert het immuunsysteem (acuut bij mensen, structureel in preklinische modellen); en het activeert “longevity-genen” zoals SIRT1 en verhoogt neurotrofe factoren zoals BDNF. Veel van deze bevindingen zijn preliminair en voornamelijk gebaseerd op diermodellen of in-vitro systemen, maar ze vormen samen een consistent beeld. De directe effecten (bv. op cellen, muizen) zijn veelbelovend en biologisch verklaarbaar, terwijl de indirecte effecten bij mensen (betere cognitie, stemming, mogelijk correlaties met vertraagde veroudering) optimisme wekken maar nader bewijs vereisen.
De huidige sterkte van het bewijs varieert per aspect. Neuroplasticiteit en ontstekingsremming door psilocybine worden ondersteund door meerdere onderzoeken (matig tot sterk bewijs). Effecten op telomeren, SIRT1 en levensduur zijn zeer recent ontdekt en nog gebaseerd op enkele studies (beperkt bewijs, maar wel baanbrekend in implicaties). Gedragsmatige “verjonging” is lastig hard te maken, maar de trends zijn bemoedigend (zwak tot matig bewijs, grotendeels correlatief of in kleine groepen). Belangrijk is dat al deze lijnen van onderzoek nog in ontwikkeling zijn. Psilocybine-onderzoek vindt voornamelijk plaats in de context van mentale gezondheidszorg; de inzichten over veroudering zijn een uitbreidend nieuw terrein.
Conclusiegewijs kunnen we stellen dat psilocybine potentie toont als een gero-protectief middel – een stof die verouderingsprocessen afremt – maar dat dit nog niet klinisch is bewezen. De convergentie van bevindingen (van cel tot gedrag) rechtvaardigt echter verder interdisciplinair onderzoek. Als vervolg zouden longitudinale studies bij mensen nuttig zijn, waarin biomarkers van veroudering (telomeerlengte, ontstekingsmarkers, cognitieve functietesten, epigenetische klokken) vóór en na therapeutisch psilocybine-gebruik gemeten worden. Tot die tijd moeten we de huidige resultaten voorzichtig interpreteren. Psilocybine is geen “fontein der jeugd” – de gegevens zijn pril en er zijn risico’s/ethische overwegingen bij ruim gebruik – maar het biedt een fascinerende inkijk in hoe veranderingen in bewustzijn en biochemie samen zouden kunnen bijdragen aan een gezonder verouderingsproces.
Bronnen: De hierboven besproken bevindingen zijn gebaseerd op een selectie van recente wetenschappelijke publicaties, waaronder cel- en dierstudies (bijv. Hecker et al., 2025 in NPJ Aging), klinische onderzoeken (Mason et al., 2023 over psilocybine en immuunmarkers; Doss et al., 2021 over cognitieve flexibiliteit) en literatuuroverzichten (Haniff et al., 2024 over psilocybine, neurogenese en microglia). Deze referenties zijn hieronder gelinkt voor verdere verdieping. Iedere deelconclusie moet dan ook gelezen worden in het licht van de genoemde bronnen en hun experimentele context. Verdere replicatie en uitbreiding van dit onderzoek zal uitwijzen of psilocybine daadwerkelijk inzetbaar wordt als senotherapeutisch middel – een spannend vooruitzicht op het snijvlak van neurowetenschap en gerontologie.